Perguntas Frequentes sobre o IVDR
O novo IVDR - In Vitro Diagnostic Regulation, em português Regulamento dos Dispositivos Médicos para Diagnóstico In Vitro (RDIV) - traz um conjunto de novas regras para garantir uma maior segurança e transparência no que diz respeito a tudo o que envolve este tipo de produtos.
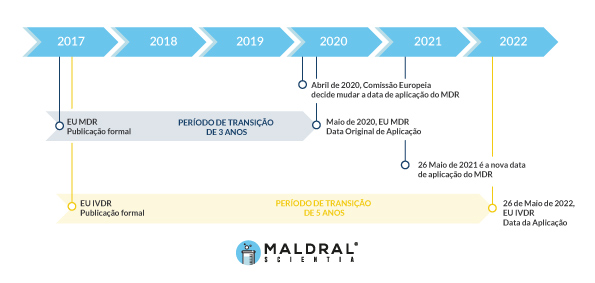
Este regulamento da UE vai afetar todos os dispositivos médicos para diagnóstico in vitro, onde se incluem os kits clínicos. O RDIV vai entrar em vigor em 26 de maio de 2022, após um período de transição que teve início em 2017.
O que é o IVDR?
Em termos práticos, o IVDR é o regulamento da UE que substituirá a Diretiva de Diagnóstico In Vitro (IVDD) 98/79/CE. A partir de maio de 2022 aumentam os requisitos regulamentares para a comercialização de dispositivos médicos de diagnóstico, onde se incluem os kits clínicos e para os laboratórios clínicos que utilizem LDts (Laboratory developed tests).
Considera-se um dispositivo médico para diagnóstico in vitro, qualquer tipo de equipamento e reagente que se utilize para a análise e monitorização de parâmetros clínicos. Assim, o IVDR vai abranger todo o processo que envolve a análise de amostras recolhidas em humanos, desde os reagentes, equipamentos, material auxiliar, incluindo softwares de análise utilizados.
Pode obter informações mais específicas sobre a aplicação deste regulamento podem consultar vários documentos publicados no site do Infarmed, nomeadamente as fichas informativas relativas ao novo regulamento.
Quais os países afetados pelo IVDR?
O IVDR aplica-se tanto aos 27 estados membros da União Europeia, como à Islândia, Liechtenstein, Noruega e Suíça. Após o Brexit, este regulamento já não será aplicado no Reino Unido.
Em todos estes países, a comercialização de dispositivos médicos para diagnóstico in vitro, bem como dos softwares ou acessórios a eles associados, terá de cumprir as exigências do referido regulamento a partir da data do início da sua obrigatoriedade: 26 de maio de 2022.
Qual a diferença entre o MDR e o IVDR?
Para aumentar o nível de segurança e controlo sobre as normas médicas, a UE já implementou o MDR, ou Medical Device Regulation. Este regulamento tem um raio de ação mais abrangente, aplicando-se a artigos tão diversos como ligaduras, cadeiras de rodas e artigos com finalidades contracetivas, como os DIUs.
A linha temporal para a implementação do MDR e do IVDR são ligeiramente diferentes, mas indissociáveis, uma vez que são regidos pelos mesmos organismos.
IVDR: O que muda com este regulamento?
De uma maneira geral, os requisitos que já eram impostos pelas diretivas anteriores não sofrem quaisquer alterações. O IVDR traz consigo um conjunto de regras adicionais que se traduzem em algumas mudanças:
- Uma das principais alterações está no novo sistema de classificação dos dispositivos, agora dividido por graus de risco;
- Passa a ser adotada uma nomenclatura normalizada, envolvendo UDIs;
- Acrescenta uma nova etapa ao processo requerendo a avaliação do desempenho clínico do dispositivo IVD;
- Redireciona a validação do dispositivo para as recomendações ICH obrigando ao cumprimento de um plano de validação analitica muito mais extenso;
- A definição dos dispositivos é alargada, incluindo nesta regulamentação elementos como softwares ou outras tecnologias digitais.
O IVDR vem ainda trazer mais clareza sobre as obrigações e as responsabilidades legais de todos os envolvidos no fabrico, comercialização, distribuição e utilização deste tipo de dispositivos para diagnóstico in vitro.
UDI e Categorias de Risco de acordo com o IVDR
Com vista a uma nomenclatura global e normalizada para os dispositivos médicos, a UE e outros países, como os EUA, estão a adotar um sistema de Unique Device Identification - UDI.
Assim, todos os dispositivos médicos abrangidos por este novo regulamento terão de ter uma UDI própria, adicional à informação do produto.

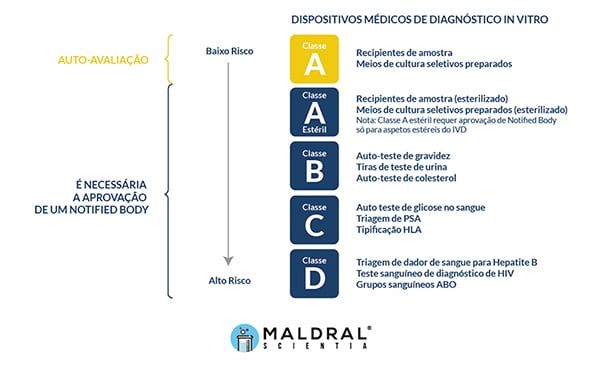
Para cumprir as normas impostas pelo IVDR, qualquer dispositivo médico para diagnóstico in vitro terá de ser classificado de acordo com o seu perfil de risco. As categorias vão desde a A (baixo risco) até à D (risco elevado) e todos os dispositivos, bem como as utilizações previstas para cada um deles, terão de ser enquadrados na categoria respetiva.
O que se pretende alcançar com estas mudanças?
Um dos principais objetivos do IVDR é demonstrar que os sistemas de gestão de qualidade, bem como os sistemas de gestão de risco que os integram, estão efetivamente a funcionar.
A nível da vigilância no período pós-comercialização, serão monitorizados fatores relacionados com segurança, desempenho clínico e análise comparativa entre riscos e benefícios.
Este novo regulamento europeu vem dar mais ênfase à necessidade de uma avaliação contínua e clínica dos produtos, garantindo assim uma melhor gestão do seu ciclo de vida. Cada certificação de conformidade destes dispositivos terá uma validade de 5 anos, recomeçando o processo de certificação no final deste período.
Na Maldral, estamos a tomar todas as providências para garantir que os nossos kits clínicos cumpram todos os requisitos para continuarmos a proporcionar-lhe os produtos adequados às suas necessidades e às do seu laboratório.
2021-08-31





